スイス製インプラントは大丈夫なのか?
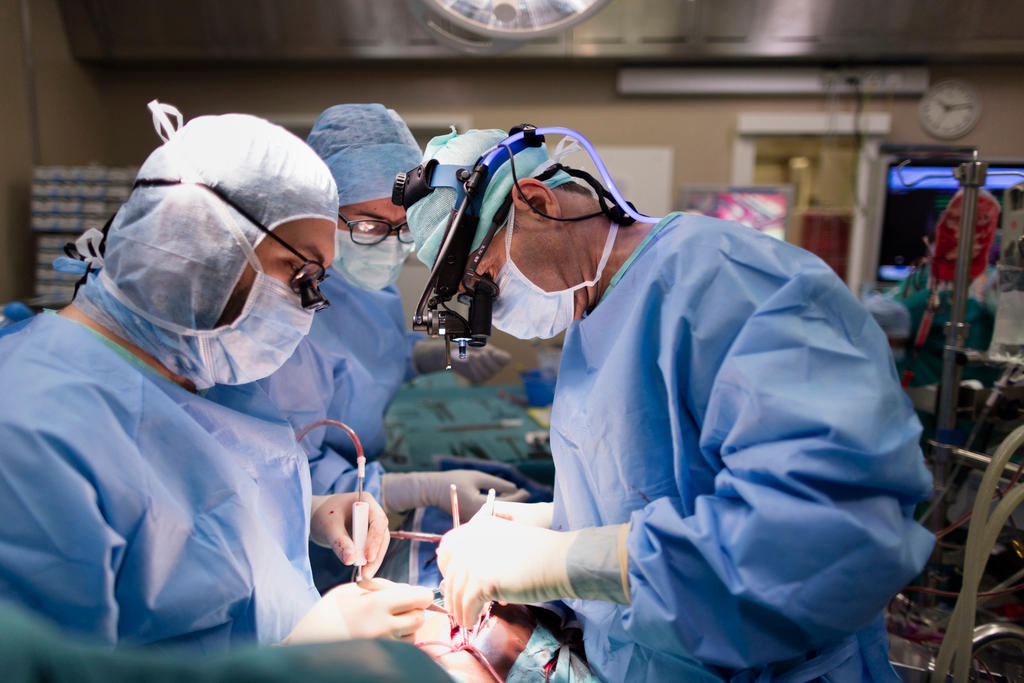
インプラントの不具合や安全基準の緩さを明らかにしたリポート「インプラントファイルズ」が公表され、急成長を続けるスイス医療機器業界に波紋が広がっている。メーカーや業界団体側は「安全基準はこの10年で改善した」と主張するが、それは果たして十分なのか。
世界的に急成長を続けるインプラント医療機器市場。人工股関節や心臓ペースメーカー、除細動器といったインプラントはすっかり一般的となった。
しかし、先日公表されたリポート「インプラントファイルズ外部リンク」によると、患者の命を救うはずのインプラントで、死亡例を含む深刻な健康リスクが多数生じている。この調査に参加したのは国際調査報道ジャーナリスト連合(ICIJ)外部リンクに所属する30カ国以上のジャーナリスト250人。スイスの大手メディア・タメディア社所属のジャーナリストも名を連ねる。
同調査によると、非標準的な試験や認可手順だけで製品の発売に踏み切るケースが頻発しており、リコールしたとしても、ほとんどの場合修復不可能なダメージは既に生じてしまっている。ドイツ語圏のスイス公共放送SRFの調べによると、昨年スイス国内で医療用インプラントが引き起こした合併症外部リンクの数は約1400件。中には脊椎インプラントが体内で分解し、長期的ダメージを引き起こすというケースもあった。
スキャンダル後の改革
インプラントメーカーを始めスイスの医療機器の業界団体「スイスメドテック外部リンク」で規制問題を担当するペーター・シュトゥーダー氏によると、ICIJが取り上げたケースは、そのほとんどが2012年に医療機器業界で実施された大規模改革以前に発生したものだという。
スイスインフォの取材に対しシュトゥーダー氏は、「インプラントファイルズの調査例は、PIPスキャンダル(仏ポリアンプランプロテーズ社が、01年から安価な工業用シリコンを原料とした乳房インプラントを非合法に製造販売していたことが発覚した事件)時かそれ以前に起きたものがメインとなっている」と文書で回答を寄せた。
特定の製品外部リンクの発売にあたっては登録認証機関が製品の順法性を審査することになっているが、PIPスキャンダル発生後は、これら登録認証機関を整理すると共に組織の質を高めるための取り組みが行われた。
問題が発生した際は医薬品認可機関「スイスメディック(Swissmedic)外部リンク」及び12年に発足した「SIRISスイスインプラント登録外部リンク」を通じて報告が行われるが、そのスピードと正確性の向上にも力を入れている。
スイスインフォの取材に対しスイスメディックは、「深刻な事例については当局がリコールや回収等、必要とされる措置を取る」とメールで回答。スイスメディックに報告されたリコールその他の「市場安全性是正措置(Field Safety Corrective Actions:FSCA)」は、すべてインターネット上外部リンクで公表される。
改革は十分?
しかし、これらは患者の安全を確保するのに十分な改革と言えるのか。世界的補聴器メーカーの一つでスイスを拠点とするソノヴァ社外部リンクは、自社の安全性確認プロセスに自信を持つ。同社の子会社であるアドヴァンスド・バイオニクス社外部リンクが製造した人工内耳装置は、2012年以前にリコールや警告、市場安全性通告を受けたとして今回ICIJデータベースに登録された7万件の中の一つだ。
スイスインフォに対しソノヴァ社は、「アドヴァンスド・バイオニクス社の品質管理システムは国際規格で認定を受けており、同社製品は市場に流通する前に監督機関で検査の上承認されている」「人工内耳装置システムの場合と同じく、製品に問題が生じた場合は監督機関に報告の上、製品の信頼性に関する文書中にその旨を記載、消費者に情報公開される」と説明した。
医療機器産業
医療機器(別称メドテック)とは、医薬品以外に医療目的で使われる器具の総称。インプラント、心臓ペースメーカー、注射器、車椅子、MRIなどが含まれる。スイスメドテックによると、スイス医療機器企業の年間売上高は158億フラン(約18兆円)、輸出高は113億フラン。国内で1400社以上を数える医療機器企業の従業員数は5万8500人以上、医療機器産業がスイスの国内総生産(GDP)に占める割合は2.3%。
また、人工膝関節および人工股関節の使用件数は4万件、眼内レンズは7万件で、心臓ペースメーカーや除細動器の埋め込み件数は4500例に上る。
しかし、ICIJは今回のリポートの中で、「インプラントの場合、処方薬とは異なり大規模な臨床実験が義務づけられていないため、欠陥機器にも当局の販売許可が下りてしまう」と主張する。
スイスメドテック外部リンクのシュトゥーダー氏は、医療機器と医薬品を同列に語るのは適切でないと論じる。医薬品の種類が1万種なのに対し医療機器は5万種、しかもその形態は様々だ。医療機器がカバーする適用例の広さを考慮すれば、「認可のプロセスをそのまま医療機器のコンプライアンス(法令順守)手続きに当てはめることはできない」(シュトゥーダー氏)。
一方、ジャーナリストらの調査によると、インプラントの不具合は埋め込み後かなり時間が経過してから生じるケースが多い。これらは動物実験時には問題が無かったものがほとんど。つまり、より厳格な試験が行われていれば、深刻な痛みや苦しみを訴える患者の発生を防げたはずだ。
スイスメディックの医療機器部門責任者ベルンハルト・ビクセル氏は、フランス語圏スイスの公共放送RTSの番組外部リンクの中で、試験や認証のシステムについての懸念は連邦議会議員外部リンクの間からも出始めていると述べた。「問題の報告義務は医師と病院が負っている外部リンクが、それが必ずしも常に実行されていない」という事実も懸念の一つだという。
求められるスピード
メドテック(医療機器)は、過去2年間で4000人分の雇用を生むなどスイスでも指折りの急成長を遂げている業種だ。国内ではインプラントメーカーを含む1400を超える企業が5万8000人以上の従業員を抱える。
この業界はジョンソンエンドジョンソン・メディカル社、ロシュ・ダイアグノスティックス社やソノヴァ社といったビッグネームを除き、スタートアップ企業が圧倒的多数。スイスメドテックが行った2018年の業界調査外部リンクによると、93%の企業が従業員250人未満、5社に4社は50人未満の規模となっている。
この事実は医薬品業界を既に長年悩ませてきたある問題にもつながっている。それは、命を救うかもしれない製品を一刻も早く市場に出したいという願望と、安全を確保するための規制強化とのバランスをどう取るのか、という問題だ。
事業規模の小さい零細企業にとってこの問題はより切実だ。前述の業界調査によると、欧州連合(EU)が新規定を導入して以来、品質要件や書類作成の必要性が増加、多くの医療機器企業がその対応に苦慮している(下枠参照)。
スイスの医療機器規制
スイス医療機器法外部リンクは2002年に発効後、EUの医療機器指令の見直しに伴い、10年に改定された。スイスとEUは相互認証に合意しているため、スイスが欧州市場監視制度に加わる一方で、スイス側にもEUに対し同等の法的要件が存在する。
17年春、欧州委員会は、医療機器(MDR)ならびに体外診断薬(IVDR)に関し、リスクマネジメントと市場監視の強化や透明性の向上といった手段で患者の安全性を大幅に向上させようと、二つの新たな規制を導入した。MDRについては20年5月から、IVDRは22年5月から、EU加盟国で義務化される。
スイス政府でも、これに合わせて医療機器法を改定すべきかどうかについて現在論議が進行中だ。
(英語からの翻訳・フュレマン直美)

JTI基準に準拠





swissinfo.chの記者との意見交換は、こちらからアクセスしてください。
他のトピックを議論したい、あるいは記事の誤記に関しては、japanese@swissinfo.ch までご連絡ください。