Der lange Weg der Medikamente zur Marktreife
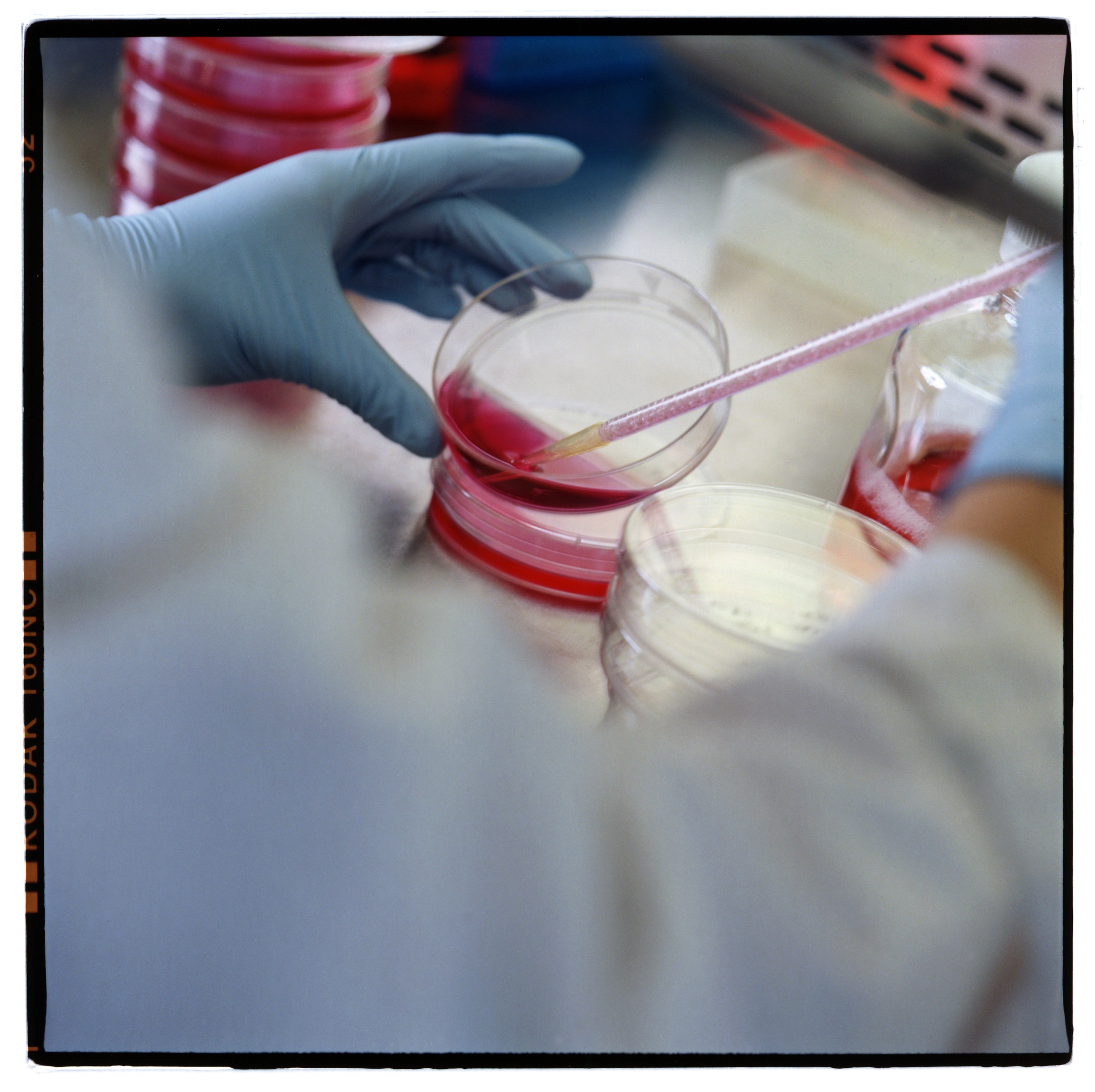
Eine Medikament von der Entdeckung zur Marktreife zu bringen, ist ein kostspieliger Prozess, der bis zu 30 Jahre dauern kann. In den vergangenen Jahren ist das Prozedere laut Pharma-Industrie und Forschungsorganisationen zudem schwerfälliger geworden.
Gesundheitsbehörden seien zurückhaltender und restriktiver geworden und verlangten zusehends weitergehende Dokumentationen, sagt Stefan Frings, Chef Medical Affairs bei der Basler Pharmafirma Roche.
Vor Jahrzehnten wurden Therapien gegen Tumore aufgrund von relativ limitierten Daten freigegeben. Heutzutage werden Medikamente lediglich für jene Tumor-Arten freigegeben, für die Studiendaten vorliegen, erklärt Frings. Damit wollen die Behörden sicherstellen, dass Medikamente sicher und effektiv sind und dass sie gegenüber bestehenden Therapien eine Verbesserung bringen.
Preis als wichtiges Kriterium
Die Zulassung für ein Medikament von Swissmedic oder der europäischen oder US-Regulierungsbehörde zu erhalten, ist lediglich eine von vielen Hürden, die überwunden werden müssen. Die Firmen müssen mit den Behörden, die über die Entschädigungen durch die Krankenkassen entscheiden, auch Preisdiskussionen führen. In der Schweiz ist dafür das Bundesamt für Gesundheitswesen zuständig.
Für die Schweizer Regierung ist ein Medikament dann kosteneffizient, wenn es die gewünschten medizinischen Effekte zu einem möglichst günstigen Preis erreicht. Die Kosteneffizienz wird laut Daniel Dauwalder, Sprecher des Bundesamtes für Gesundheit, im Vergleich mit andern Therapien und auch im Vergleich mit dem Preis des Medikaments in andern Ländern evaluiert.
Mehr
Das Geschäft mit der Krebsforschung
Geringe statistische Wahrscheinlichkeit
Die grösste Hürde, die ein Medikament auf seinem Weg vom Labor zur Anwendung nehmen muss, ist die statistisch geringe Wahrscheinlichkeit, dass dies auch gelingt. Die Chancen stehen nämlich nur 1:5000, wie das Tufts Center for the Study of Drug Development schätzt. Die Entwicklungskosten für ein Medikament belaufen sich laut einer 2006 publizierten Gesundheitskostenstudie auf bis zu rund 1.9 Milliarden Franken.
Der erste Schritt bei der Entwicklung eines Krebs-Medikamentes ist die Klärung der Frage, wie ein Krebs in den menschlichen Körper eindringt. «Je besser Sie die Krankheit verstehen, umso besser können Sie die Patienten identifizieren und eine Therapie entwickeln», sagt Frings.
«Gewisse Moleküle erweisen sich bereits in früheren Phasen der Entwicklung als vielversprechend. Bei Zelboraf wussten wir bereits in der ersten Phase, dass wir damit ein Medikament entwickelt hatten. In diesem einmaligen Fall dauerte es lediglich fünf Jahre bis zur Zulassung durch die US-Behörden.» Zelboraf ist in den USA und in Europa als Medikament gegen eine bestimmte Art von Hautkrebs auf dem Markt.
Lange Durststrecken
Normalerweise dauert es bis zur Zulassung von Medikamenten bis zu 30 Jahre und im Durchschnitt mehr als 10 Jahre. Perjeta, das Brustkrebs-Medikament von Roche, wurde in Europa vor wenigen Wochen zugelassen, ein Vierteljahrhundert, nachdem die Basis dazu entdeckt worden ist.
«Eine Firma muss imstande sein, 10 oder 20 Jahre zu überleben und die Forschung voranzutreiben. Wenn das nicht gelingt, ist sie früher oder später weg vom Fenster», sagt Frings.
Zahlreiche erfolgreiche Krebsmedikamente sind das Resultat von Grundlagenforschungen an Universitäten oder Forschungsinstituten. Diese Projekte werden in der Schweiz meistens von Institutionen wie der Krebsliga oder dem Nationalfonds (mit)finanziert.
Der Nationalfonds ist die wichtigste schweizerische Institution im Bereich der Grundlagenforschung. Zwischen 2008 und 2012 hat der Bund mehr als 100 Millionen Franken in die Krebsforschung investiert. In den kommenden Jahren werden die Beträge weiter steigen, sagt Nationalfonds-Sprecher Ori Schipper.
Lediglich eines von 5000 Medikamenten, die als Kandidaten antreten, schaffen es bis zur Marktzulassung.
Von zwischen 5000 und 10’000 Kandidaten für ein neues Medikament schaffen es lediglich 250 bis zu Versuchen an Tieren.
Rund 10 davon werden zu klinischen Testen zugelassen.
Laut dem in Boston domizilierten Tufts Center for the Study of Drug Development schaffen es von den 10 lediglich 2 bis zu einer eventuellen Marktzulassung.
Mehrere Phasen
Ergebnisse der Grundlagenforschung werden vielfach erst viel später im Medikamenten-Entwicklungsprozess verwertet. Dann, wenn es klarer geworden ist, welche Rolle sie bei der Krankheit spielen. Laut Frings tragen Entdeckungen aus den 1990er-Jahren noch heute zur Entwicklung neuer Medikamente bei.
Eine erfolgreiche Entdeckung ist lediglich ein erster Schritt. Kleine Biotech-Firmen suchen die potentiellen Kandidaten und testen anschliessend die Moleküle. Später werden die Kandidaten, die immer noch im Rennen sind, an grosse Pharmafirmen wie Roche oder Novartis verkauft.
Medikamenten-Entwickler testen die neuen Chemikalien im Labor und anschliessend an Menschen. Dabei untersuchen sie zuerst deren Sicherheit und anschliessend die Effizienz. In einer dritten Phase werden die neuen Medikamente mit den bereits existierenden Therapien verglichen. In der Schlussphase werden die Medikamente von den Behörden zugelassen.
Hohe Regeldichte
Die regulatorischen Anforderungen betreffen nicht nur die Entwickler von Medikamenten, sondern auch Forschungsinstitutionen, die klinische Tests durchführen. Laut der Schweizerischen Gesellschaft für klinische Krebsforschung (SAKK) sind die Zulassungen für neue Medikamente durch Swissmedic zwischen 2005 und 2011 um 40% zurückgegangen.
«Der Grund für diesen Rückgang ist eine Überregulierung. Das macht die Schweiz unattraktiv, weil die Prozesse teuer und langsam sind», sagt SAKK-Präsident Beat Thürlimann.
Laut Swissmedic-Sprecher Daniel Lüthi haben sich die Prinzipien, nach denen Swissmedic die Gesetze anwendet, nicht geändert. Lüthi räumt allerdings ein, dass das wissenschaftliche und technische Wissen in den vergangenen Jahren stark zugenommen und sich damit auch die regulatorischen Anforderungen in den vergangenen 20 Jahren «enorm entwickelt» haben.
Für den Onkologen Thürlimann sind neue Krebstherapien jedoch dringender denn je. In der Schweiz werden jährlich 40’000 neue Krebsfälle registriert. Laut der Schweizerischen Krebsliga sterben in der Schweiz jährlich 16’000 Menschen an Krebs.
(Übersetzung aus dem Englischen: Andreas Keiser)

In Übereinstimmung mit den JTI-Standards








Einen Überblick über die laufenden Debatten mit unseren Journalisten finden Sie hier. Machen Sie mit!
Wenn Sie eine Debatte über ein in diesem Artikel angesprochenes Thema beginnen oder sachliche Fehler melden möchten, senden Sie uns bitte eine E-Mail an german@swissinfo.ch