
Medicamento de Roche bajo vigilancia en EE UU
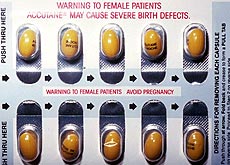
El gobierno estadounidense impone medidas excepcionales para controlar la prescripción de Accutane, que, al parecer, provoca efectos secundarios que pueden ser mortales.
Esta medicina contra el acné severo sería la causa de malformaciones en recién nacidos y suicidios entre algunos pacientes.
Ante riesgos excepcionales, medidas excepcionales. La Administración de Alimentos y Medicamentos de Estados Unidos (Food and Drug Administration, FDA) anunció la adopción de medidas muy estrictas para controlar el uso de Accutane en ese país.
Este medicamento de Roche se prescribe para las formas graves del acné. Se le atribuyen malformaciones en bebés, cuyas madres ingirieron el fármaco. También se cree que ha influido en el estado psíquico de algunos pacientes, conduciéndolos al suicidio.
A partir del 22 de agosto pasado y hasta el 31 de diciembre próximo, todos los pacientes que tomen estas pastillas, sean hombres o mujeres, deberán inscribirse en una lista de control, al igual que médicos y farmacéuticos que las receten o vendan.
Además, todos los pacientes que traten su acné con Accutane deberán firmar un documento en el que aseguren haber sido informados de sus riesgos.
Las mujeres, antes de iniciar el tratamiento con estas cápsulas, tendrán que presentar los resultados negativos de un examen de embarazo y deberán mantener medidas anticonceptivas
Para recibir una nueva receta será necesario someterse a un nuevo examen de embarazo, una forma de evitar toda posibilidad de malformaciones fetales.
Polémica a escala nacional
Accutane fue aprobado por la instancia estadounidense de reglamentación farmacéutica desde hace 23 años. Y desde entonces están en tela de juicio sus efectos secundarios.
A partir de 1982, esta dependencia gubernamental ha registrado malformaciones en más de 160 bebés, cuyas madres habían tomado Accutane, antes o durante el embarazo.
En el caso de la tendencia suicida que se le adjudica, se han contabilizado al menos 200 suicidios en pacientes a los que se les recetó el producto de Roche.
La polémica en torno a estas pastillas había permanecido en los círculos de la prensa especializada y en algunas asociaciones de consumidores.
Sin embargo, el 18 de noviembre pasado, el médico-consejero de la Administración de Alimentos y Medicamentos de Estados Unidos, David Graham, solicitó al Senado el retiro del medicamento del mercado nacional.
El órgano estadounidense de control de medicamentos no va tan lejos como lo solicitó su consejero, pero establece un sistema específico de vigilancia que se impone, esta vez, de forma obligatoria.
Roche se concreta a su comunicado
Contactado por swissinfo, Terry Hurley, el director de Relaciones Públicas de la filial estadounidense de Roche, rechaza responder a toda cuestión relacionada con Accutane, sosteniendo que la posición oficial del grupo suizo ha sido divulgada a través de un comunicado.
En este documento, Roche se dice «satisfecho» del «programa reforzado de gestión de riesgos» adoptado por la FDA.
La multinacional helvética agrega que «trabaja desde hace 23 años con la FDA sobre la evolución de los programas de gestión de riesgos en la prescripción de Accutane», y califica esta colaboración de «ejemplar».
Para el diputado estadounidense Bart Stupak se trata, por cierto, de un mal ejemplo. Este demócrata, quien representa al estado de Michigan en la Cámara de Representantes, se ha confrontado de cerca con sus riesgos.
El 14 de mayo de 2000, su hijo de 17 años, BJ, que tomaba el medicamento desde hacia varios meses, se quitó la vida con un arma de fuego. Para Bart Stupak, las nuevas reglas de control obligatorio son insuficientes.
«Estas medidas ignoran la mitad de los problemas asociados con la ingestión de Accutane, ya que no mencionan los efectos secundarios de carácter psíquico. Me temo que habrá nuevos casos de malformaciones y de suicidios», declara Stupak a swissinfo.
Solicitud para retirarlo del mercado
El legislador muestra su sorpresa ante el hecho de que la FDA no haya impuesto límites en la dosificación del medicamento.
El diputado exige que Accutane sea «retirado del mercado hasta que su dosificación y los trastornos psíquicos que genera sean esclarecidos». «Pido que la FDA retire del mercado este medicamento porque sus riesgos rebasan las ventajas que ofrece y porque ya existen mejores medicamentos para el acné», argumenta.
A su juicio, las medidas de la FDA no defienden «el interés del pueblo estadounidense» y Roche «sitúa sus ganancias por delante de la protección del consumidor».
Accutane debe ser prescrito únicamente en casos severos de acne, sin embargo, el medicamento es frecuentemente utilizado en pacientes con oclusiones de poros comunes.
De acuerdo a la FDA, cada mes se emiten 100.000 recetas de Accutane y sus versiones genéricas en Estados Unidos.
swissinfo, Marie-Christine Bonzom, Waschington
Traducido del francés por Patricia Islas
A partir del 22 de agosto y hasta el 31 de diciembre próximo, todos los pacientes que tomen Accutane deberán inscribirse obligatoriamente en una lista de control nacional.
Los médicos y farmacéuticos que prescriban o vendan el medicamento también deben incluir la información en el listado.
Accutane se vende en EE UU desde hace 23 años.
Desde 1982, el órgano de control estadounidense ha registrado 200 suicidios en personas que lo tomaron y malformaciones en más de 160 bebés, cuyas madres lo ingirieron, antes o durante el embarazo.

En cumplimiento de los estándares JTI
Mostrar más: SWI swissinfo.ch, certificado por la JTI














![El cuadro "Sonntag der Bergbauern" [Domingo de los campesinos de montaña, 1923-24/26], de cuatro metros de largo, tuvo que ser retirado con una grúa de la Cancillería alemana en Berlín para su exposición en Berna.](https://www.swissinfo.ch/content/wp-content/uploads/sites/13/2025/12/01_Pressebild_KirchnerxKirchner.jpg?ver=9ea46444)







Puede encontrar todos nuestros debates aquí y participar en las discusiones.
Si quiere iniciar una conversación sobre un tema planteado en este artículo o quiere informar de errores factuales, envíenos un correo electrónico a spanish@swissinfo.ch.